LES COMPOSES AROMATIQUES : LE BENZENE
EXERCICE 1
1. Nommer ces composés aromatiques
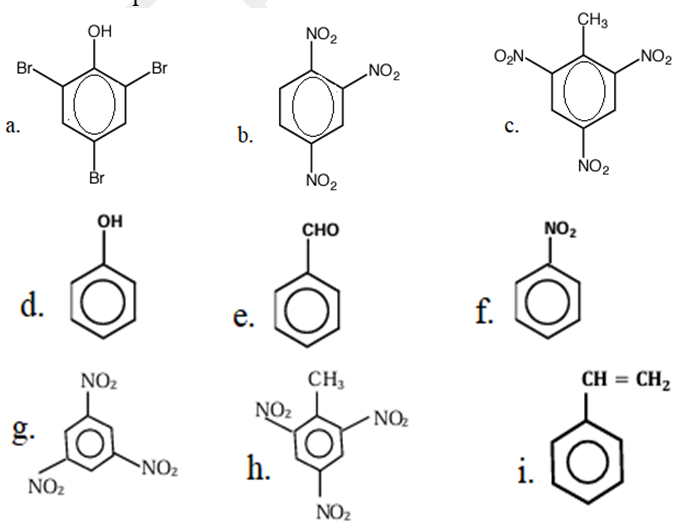
2. Écrire les formules sémi-développées des hydrocarbures dont les noms suivent :
a.$ 1, 3, 5-trinitrobenzène $
b. $orthodipropylbenzène$
c. $1, 3, 5-trichlorobenzène $
d. $2, 4, 6-trichlorotoluène$
e. $2, 4, 6-trinitrotoluène $
f. $Paraxylène$
3. Écrire les équations de réactions suivantes en déterminant les formules des réactifs et produits.
3.1 $Benzène + dichlore$ en présence de chlorure de $fer (III)$
3.2 $Benzène + dichlore$ en présence de la lumière.
4. Un dérivé bromé du benzène contient en masse $50,96 %$ de brome.
4.1. Déterminer la formule du dérivé. Le catalyseur est le chlorure d’aluminium $AlCl_{3}$.
4.2. Écrire l’équation-bilan traduisant l’obtention de ce produit à partir du benzène.
5. Donner les noms et les formules des composés obtenus par les réactions suivantes :
$Benzène + 3H_{2} → A
Toluène + 3H_{2} → B
Benzène + Cl_{2} → D + HCl
D + Cl_{2} → E + HCl$
EXERCICE 2
Un hydrocarbure aromatique $A$, liquide à température ordinaire, admet comme proportion en masse, $10,5$ fois plus de carbone que d'hydrogène.
Sa masse molaire moléculaire est $M = 92g/mol$.
1. Déterminer les formules brutes et semi-développées, ainsi que le nom du composé $A$.
2. L'hydrogénation de A en présence du Nickel donne un composé saturé $B$.
Donner la formule semi développée et le nom de $B$.
3. L'action contrôlée du dichlore sur le composé $A$ en absence de la lumière et en présence du $FeCl_{3}$ donne un composé $C$ contenant $28,06%$ en masse de chlore et un gaz dont la dissolution dans l'eau donne une solution acide.
Montrer que cette action du dichlore est une mono substitution et donner les formules développées possibles du composé $C$ obtenu.
EXERCICE 3
On veut déterminer la formule semi-développée d'un hydrocarbure $A$, de formule brute $C_{14}H_{12}$.
Des expériences montrent que cet hydrocarbure a les propriétés suivantes:
- il décolore l'eau de brome ;
-par hydrogénation totale, $18g$ de l'hydrocarbure $A$ fixe $15,68L$ d'hydrogène.
1. Déterminer les deux formules développées compatibles avec les renseignements ci-dessus.
2. L'hydrocarbure $A$ est obtenu par hydrogénation catalytique sur le palladium désactivé d'un hydrocarbure $A'$.
A peut à son tour, être hydrogéné à température et pression ordinaires, sur nickel divisé.
On obtient $B$.
$B$, soumis à une hydrogénation sur le platine, à température et pression élevées, conduit à un hydrocarbure $C$.
Lorsque, par ailleurs, l'hydrocarbure $B$ est exposé à la lumière en présence du dichlore, il donne naissance à un produit monochloré unique $D$ et à un dégagement de chlorure d’hydrogène $HCl$.
2.1. En déduire la formule brute et la formule semi-développée de chacun des composés$ A', B, C$ et $D$h.
2.2. Lequel des composés $A', B, C$ et $D$ possède des isomères $(Z)$ et $(E)$?
Représenter ces isomères.
2.3. Ecrire les équations de toutes les réactions
EXERCICE 4
On laisse tomber une goutte de benzène de masse volumique $µ=880kg/m^{3}$ dans un flacon de $250 cm^{3}$ rempli de dichlore.
Le flacon est ensuite exposé à la lumière solaire.
1. Qu'observe-t-on dans le flacon après quelques instants?
2. Ecrire l'équation bilan de la réaction qui a lieu et donner le nom du produit obtenu.
3. On admet qu'une goutte de benzène a un volume de $0,05cm^{3}$ et que le volume molaire est de
$25L.mol^{-1}$ dans les conditions de l'expérience.
3.1. Le dichlore est-il entièrement consommé dans cette réaction?
3.2. Quelle masse de cristaux peut-on recueillir dans cette opération?
EXERCICE 5
Un hydrocarbure A de masse molaire $M_{A} = 106 g/mol$, mène par hydrogénation, à un composé saturé $B$ de masse molaire $M_{B} = 112 g/mol$.
Par ailleurs, $B$ contient en masse $6$ fois plus de carbone que d’hydrogène.
2. Déterminer la formule brute de $B$.
En déduire que celle de $A$ est $C_{8}H_{10}$.
3. On réalise la chloration de $A$ en présence de chlorure d’aluminium utilisé comme catalyseur.
On obtient un composé organique de substitution C contenant en masse $25,3%$ de chlore.
3.1. Déterminer la formule brute de $C$.
3.2. Que peut-on dire de l’hydrocarbure $A$ ?
Justifier la réponse.
.4.Le composé $A$ peut-être obtenu par une réaction entre le monochloroéthane sur le benzène.
4.1. Traduire cette réaction par une équation-bilan.
4.2. Identifier les composés $A$ et $B$.
Ecrire une formule semi-développée et le nom de $C$.
5. On réalise la mononitration de l’hydrocarbure $A$ en présence d’acide sulfurique $(H_{2}SO_{4})$ concentré.
On obtient un composé organique $D$ comportant un groupe nitro en position para du groupe alkyle.
5.1. Ecrire l’équation-bilan de la réaction et nommer le produit $D$.
5.1. Déterminer la masse$ m’$ du produit $D$ obtenu sachant que le rendement de la réaction est de $93%$ et que la masse $m$ de $A$ est de $21,2g.
M (H)=1g/mol ; M(C)=12g/mol ; M(O)=16g/mol ; M(N) =14g/mol ; M(Cl) =35,5g/mol$
EXERCICE 6
1. Un alkyl benzène $A$ de masse molaire $M_{A}=106 g/mol$ peut être obtenu en faisant réagir un chlorure d’alkyle $CnH_{2}n+1Cl$ sur le benzène en présence de chlorure d’aluminium $AlCl_{3}$ utilisé comme catalyseur.
Déterminer la formule semi développée de l’alkyl benzène $A$ et celle du chlorure d’alkyle, et les nommer.
2. On réalise la chloration de $A$ en présence de chlorure d’aluminium utilisé comme catalyseur.
On obtient un composé aromatique $B$ contenant en masse $25,3%$ de chlore (substitution en para et / ou ortho du groupe alkyle).
Ecrire les formules semi développées des isomères de $B$ et les nommer.
3. On réalise la mono nitration d’une masse $m = 21,2g$ de l’alkyl benzène en présence d’acide sulfurique $H_{2}SO_{4}$ concentré.
On obtient un composé aromatique $C$ comportant un groupe nitro en position para du groupe alkyle.
3.1. Ecrire l’équation bilan de la réaction et nommer le produit $C$
3.2. Déterminer la masse m’ de produit $C$ obtenu sachant que le rendement de la réaction est de $93%$.
EXERCICE 7
La chimie organique est la chimie des composés du carbone, que ces composés soient naturels ou artificiels.
Outre que le carbone, les composés organiques contiennent un nombre limité d’éléments :$ hydrogène, azote, oxygène, phosphore, chlore$, etc.
L’objectif de cet exercice est de déterminer la composition d’un composé organique.
Un composé organique $A$ toxique, cancérigène et pouvant exploser au moindre choc, est essentiellement formé de carbone, d’hydrogène, d’oxygène et d’azote.
La destruction d’une masse $m = 125,00 mg$ de $A$, produit une masse $m_{1} = 154,92 mg$ de dioxyde de carbone et une masse $m_{2} = 15,86 mg$ d’eau.
Par ailleurs, la destruction d’une même masse de $A$ produit un volume $V = 2,166.10-5 m^{3}$ de diazote ; volume mesuré dans les conditions où la température vaut $27°C$ et la pression $1,013.105 Pa$.
1. Déterminer la composition centésimale massique du composé A.
2. Sachant que la densité de vapeur du composé $A$ est voisine de $7,344$, déterminer sa masse molaire et en déduire sa formule brute.
3. En présence de lumière, une mole de $A$ peut fixer trois moles de dichlore pour donner un composé $B$.
A peut aussi réagir avec le dibrome en présence de tri bromure de fer pour donner un produit de substitution $C$ contenant en masse $53,33%$ de brome.
3.1. Que peut-on dire du composé $A$ ?
3.2. Ecrire les formules semi-développées possibles de $A$ et les nommer.
3.3. Quelle(s) est (sont) la (les) formule(s) semi-développée(s) possible(s) de $B$ ?
Traduire par une équation sa formation.
3.4. Déterminer la formule brute de $C$ puis écrire sa formule semi-développée et le nommer.
Traduire par une équation sa formation.
4. De quel hydrocarbure $D$ peut-on partir pour obtenir $A$ ?
Ecrire l’équation-bilan de la réaction correspondante.
5. Quel composé organique $E$ obtient-on par action de$ $D$ sur le monochlorométhane en présence de $AlCl^{3}$ ?
Ecrire l’équation-bilan de la réaction et donner le nom du composé $E$.
Données : Masses molaires atomiques en $g.mol^{-1} : H = 1 ; C = 12 ; N = 14 ; O = 16 ; Br = 80$.
Constante des gaz parfaits : $R = 8,31S.I.$
EXERCICE 8
On réalise la mononitration du toluène $C_{6}H_{5}-CH_{3}$
1. Écrire l'équation bilan de la réaction et la formule sémi-développée du compose obtenu sachant que la nitration s’effectue surtout en position para rapport au groupement méthyle.
Préciser les conditions expérimentales.
2. Le para nitrotoluène est un liquide de masse volumique $l100kg/m^{3}$.
Déterminer la quantité de matière totale de nitrotoluène que l’on peut fabriquer à partir de $l00 kg$ de toluène sachant que le rendement de la réaction est de $90%$.
3. En réalité. il se forme $2%$ de méta nitrotoluène et $0,5%$ d’orthonitrotoluène.
Calculer alors le volume de para nitrotoluène obtenu.
EXERCICE 9
Trois hydrocarbures possèdent chacun sept atomes de carbone.
Leurs compositions centésimales massiques en hydrogènes sont: $8,69% ; 14,28% ; l6%$.
1. Donner les formules brutes qui correspondent à ces hydrocarbures.
2. On note les hydrocarbures par $A, B$ et $C$ ; sachant que :
Le composé B peut donner par hydrogénation catalytique le composé $A$
Les composés $A$ et $C$ donnent des réactions de substitutions mais ne donnent pas des réactions d’addition
Le composé $B$ peut donner à la fois des réactions de substitutions et des réactions d’addition.
2.1. Identifier $C$ par sa formule brute.
2.2. Donner les formules semi-développées et les noms de $A$ et $B$.
3. En présence du tribromure de fer $IIl (FeBr_{3}); B$ réagit avec le bromométhane pour donner un composé $D$.
3.1. Écrire les formules semi-développées possibles de $D$ et les nommer.
3.2. Déterminer la formule semi-développée précise de $D$, sachant que sa monochloration en présence de $(AlCl_{3})$ ne peut donner qu’un seul isomère.
En déduire l’équation-bilan de cette réaction.
EXERCICE 10
Un composé $A$ de formule brute $C_{8}H_{10}$ possède les propriétés suivantes : en présence de $Br_{2}$ et avec le $Fe A$ donne un produit de substitution contenant $43%$ de brome, par hydrogénation de $A$ en présence d’un catalyseur on obtient $C_{8}H_{16}$
1. Que peut-on déduire quant à la nature du produit $A$?
Montrer que l'action du dibrome est une monosubstitution
2. Proposer les différentes formules semi développé de $A$
3. À partir du produit $A$, on peut préparer le styrène qui par polymérisation donnera le polystyrène
Quelle est la formule semi développé de $A$??
EXRCICE 11
Un corps $A$ de masse molaire $78g/mol$ renferme en masse $92.3%$ de carbone et $7.7%$ d’hydrogène.
1. Trouver la formule brute du composé.
2. Ce composé réagit avec le dihydrogène et donne du cyclohexane.
2.1. Nommer le corps A et donner sa formule développée.
2.2. Écrire l’équation de la réaction. Quel est le nom de la réaction correspondant?
2.3. Quel volume de dihydrogène mesuré dans les $CNTP$ faut-il utiliser au cours de la réaction si on utilise $19,5g$ du composé $A$ ?
EXERCICE 12
Le benzène est obtenu par polymérisation de l'acétylène.
1. Définir le terme polymérisation.
2. Donner la formule développée du benzène.
3. Ecrire l'équation-bilan de la réaction.
4. On réalise la nitration du benzène en faisant tomber goutte à goutte du benzène dans l'acide nitrique.
On obtient le mononitrobenzène.
4.1. Ecrire l'équation de la réaction.
4.2. Préciser les modifications des conditions expérimentales si on veut obtenir au terme de cette nitration la formation du $1,3,5-trinitrobenzène$.
4.3. En utilisant les formules développées, écrire l'équation-bilan conduisant au $1, 3,5-trinitrobenzène$.
4.4. Le rendement de la réaction étant $90%$, quelle masse de trinitrobenzène obtient-on par action de $100g$ de benzène sur un excès de mélange sulfurique
EXERCICE 13
1. La fabrication du styrène ou vinylbenzène peut se résumer par l'équation bilan suivante
$C_{6}H_{6}+ CH_{3} – CH_{2}Cl ¾¾® C_{6}H_{5} – CH = CH_{2} + HCl + H_{2} $
1.1. Donner les noms des deux réactifs utilisés
1.2. Quelle masse de styrène peut-on théoriquement obtenir en consommant une tonne de benzène ?
2. Le polystyrène est obtenu par synthèse à partir du styrène :
2.1. A quel type de réaction appartient cette synthèse ?
2.2. Ecrire l’équation bilan de cette réaction
2.3. Déterminer la masse molaire du polystyrène obtenu, sachant que son degré de polymérisation vaut
$n = 2000$
