ALCANES
EXERCICE 1
1. Nommer les alcanes suivants :
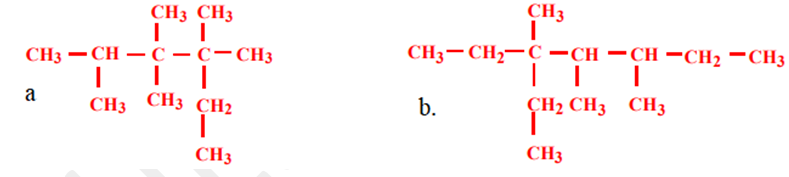
2.. Ecrire les formules semi-développées des composés suivants :
a.$2, 3- diméthylpentane $
b. $3, 4,5-triéthyloctane$
c.$ 1,2-dibromo-1,1, 2,3-tétrachlorobutane $
d. $4-éthyl-4-méthylheptane$
e. $3-éthyl-3,4-diméthylhexane$ ;
f. $4-bromo-3,5-dichloro-2,3, 6-triméthyl-5-isopropyloctane$
3. Représenter la formule semi-développée des composés suivants et donner leur formule brute:
a.$ 2,2 - diméthyl–3–éthylpentane $ b. $2, 2, 3, 5–tétraméthyl–3, 4– diéthylhexane $
c.$ 3–méthyloctane $ d. $2,6–diméthyl –3,5– diéthyl –4–propylheptane$
EXERCICE 2
Un alcane, présent dans le carburant $GPL$, a pour masse molaire $M = 58g.mol^{-1}$.
1. Écrire la formule générale d'un alcane à $n$ atomes de carbone.
2. Trouver l'expression de la masse molaire de l'alcane en fonction de $n$.
3. Déterminer sa formule brute.
4. Combien y-a-t-il de formules développées possibles ?
Représenter-les.
EXERCICE 3 Combustion du gasoil
Un des principaux constituants du gasoil a pour formule brute $C_{16}H_{34}$.
1. A quelle famille d'hydrocarbures appartient ce constituant ?
2. La combustion complète de ce composé a pour équation:
$C_{16}H_{34} + 49/2 O_{2} → 16CO_{2} + 17H_{2}O$
Calculer le volume de dioxygène nécessaire pour brûler $1kg$ de carburant assimilé à $C_{16}H_{34}$.
3. Sachant que l'air contient $20 %$ en volume de dioxygène $O_{2}$, déduire de la question précédente le volume d'air utile.
4. En fait une partie du gasoil subit une combustion incomplète.
A quelle condition une combustion est-elle incomplète ?
5. Dans certaines conditions, la combustion de $C_{16}H_{34}$ produit uniquement du monoxyde de carbone et de l'eau.
Écrire l'équation bilan de cette réaction.
EXERCICE 4 Mélange carburant - air
On désire étudier la richesse du mélange « carburant- air » admis dans un cylindre d’un moteur thermique.
La richesse de ce mélange est caractérisée par un coefficient noté $K$:
Si $K < l$, on dit que le mélange est riche. Si $K >1$, on dit que le mélange est pauvre.
On admettra que le carburant utilisé est principalement constitué d'octane de formule brute $C_{8}H_{18}$.
Dans les conditions du fonctionnement étudié,
- le volume d'un cylindre du moteur est de $400 cm^{3}$
- la masse de carburant à l’état gazeux injectée par cylindre et par admission est de $22,8mg$
- le volume molaire gazeux est de $30L.mol^{-1}l$.
A quelle famille d’hydrocarbures l’octane appartient-il ?
Justifier.
2. Écrire et équilibrer l’équation bilan de la combustion complète de 1‘octane.
3. Calculer la quantité de dioxygène $nO_{2}$, exprimée en moles admise dans un cylindre pour assurer une combustion dans les conditions stœchiométriques.
4. En déduire le volume de dioxygène $VO_{2}$, et le volume d'air Vair correspondants.
Rappel: l'air comporte $20%$ de dioxygène en volume.
5. Le coefficient $K$, sans unité, est alors défini par le rapport: $K= V/V0$ où $V$ est le volume d'un cylindre du moteur et $V_{0}$ le volume d’air nécessaire à la combustion du carburant dans les conditions stœchiométriques dans un cylindre.
Ces deux volumes sont pris dans les mêmes conditions de température et de pression. Déterminer $K$, au centième près, dans ces conditions.
6- Le mélange est-il riche ou pauvre ?
Justifier.
EXERCICE 5 Pots catalytiques
Les « pots catalytiques » sont utilisés pour éliminer les espèces les plus toxiques présentes dans les gaz d'échappement des moteurs à combustion interne:
il s'agit principalement du monoxyde de carbone $CO$, du monoxyde d'azote $NO$, et des hydrocarbures imbrûlés de formule moyenne $C_{8}H_{18}$.
1. Les mélanges de $CO$ et de $NO$ sont transformés en $CO_{2}$ et en $N_{2}$.
Établir l'équation de cette réaction avec les nombres stœchiométriques entiers les plus petits possibles..
2. A quelle famille appartiennent les hydrocarbures imbrûlés (justifier) ?
3. Les hydrocarbures imbrûlés sont oxydés (réaction avec le dioxygène) en $CO_{2}$ et en $H_{2}O$.
Établir l'équation de cette réaction.
EXERCICE 6 pouvoir calorifique du butane
Une bouteille de butane contient $13kg$ de cet hydrocarbure de formule $C_{4}H_{10}$ conditionné à l'état liquide.
1. Écrire l'équation chimique équilibrée de la combustion complète du butane dans le dioxygène, mettant en jeu une mole de butane.
2. Quel est le nombre de moles de butane que contient la bouteille ?
3. Quel est le volume d'air nécessaire à la combustion du contenu de la bouteille ?
On négligera la quantité de gaz résiduel qui ne sort pas de la bouteille.
4. Écrire les formules développées des différentes espèces mises en jeu dans la réaction de combustion.
5. On appelle « pouvoir calorifique massique » l'énergie thermique libérée par la combustion d'un kilogramme de combustible.
Déterminer le pouvoir calorifique massique (en $kJ.kg^{-1})$ du butane.
7. En déduire l'énergie thermique totale obtenue en brûlant le contenu d'une bouteille de $13kg$ de butane.
EXERCICE 7 Combustion des carburants dans l'air
On désire comparer l'essence, le gazole et le $GPL$; l'essence sera modélisée par le nonane ($9$ atomes de carbone), le gazole par l'heptadécane ($17$ atomes de carbone)$$ et le $GPL$ par le butane.
1. Écrire les réactions de combustion complète de ces trois hydrocarbures dans l'air.
Le rendement des moteurs n'est pas le même suivant le carburant qu'ils utilisent; par exemple, un même véhicule motorisé différemment consomme $7,5 L$ de gazole, $9,0 L$ d'essence ou $10,5L$ de $GPL$ par $100 km$.
2. Calculer la quantité de matière de butane, de $\text{nonane}$ ou d$\text{l'heptadécane}$ que consomment ces moteurs pour $100 km$ si la combustion est complète.
Masses volumiques en $kg/L$: gazole: $0,84$ essence: $0,74 GPL: 0,56$
3. Pour une automobile, on précise désormais la masse de dioxyde de carbone qu'elle rejette à chaque kilomètre.
Déterminez cette masse pour les trois moteurs étudiés.
4. On lit dans la presse que les moteurs Diesel qui consomment moins rejettent moins de dioxyde de carbone: qu'en pensez- vous ?
5. Quels autres gaz sont émis lors de la combustion des carburants ?
EXERCICE 8
1. Donner les noms et les formules semi-développées de $5$ des isomères de l’alcane de formule brute $C_{7}H_{16}$.
Le cétane $C_{16}H_{34}$ est le constituant essentiel du gazole.
Sa combustion complète dans l’oxygène de l’air donne du dioxyde de carbone et de l’eau.
2. Recopier et équilibrer l’équation de la combustion suivante :
$…… C_{16}H_{34} + …… O_{2} \rightarrow …… CO_{2} + …… H_{2} O$
EXERCICE 9
Un véhicule consomme $8 L$ de carburant aux $100km$.
L’essence correspond à un alcane $C_{8}H_{18}$ de masse volumique $700 kg/m^{3}$.
1. Ecrire et équilibrer la réaction de combustion de cet octane dans l’oxygène de l’air.
2. Calculer la masse de cet octane consommé pour $450 km$.
3. En déduire le volume de dioxygène consommé pour ce trajet ainsi que le volume de $CO_{2}$ dégagé.
Données: $M_{C} = 12g/mol ; M_{H} = 1g/mol ; Vmol = 24L/mol$
EXERCICE 10
Donner la formule semi-développe des alcanes ci-dessous
а) $2,2, 3,4-tétraméthylpentane$
b) $4-tert-butyl-3-méthyloctane $
c)$ 3,4-diméthyl-4-isopropylheptane $
d) $4-éthyl-3,4-diméthylhexane$
EXERCICE 11
On réalise la combustion de $20,01kg$ de gaz butane selon l’équation bilan suivante :
$2C_{4}H_{10} + 13O_{2} → 8CO_{2} + 10H_{2}O$
Un élève de la classe de troisième souhaite calculer, la masse de dioxyde de carbone rejeté dans l’atmosphère au cours de cette combustion.
Il est un peu perdu, viens-lui-en aide pour répondre aux questions suivantes. Calculer :
1. la quantité de butane brûlé ;
2. la quantité de dioxyde de carbone rejeté au cours de cette combustion
3. la masse de dioxyde de carbone rejeté dans l’atmosphère.
On donne : $M(C_{4}H_{10}) = 58g/mol ; M(CO_{2})= 44g/mol$
EXERCICE 12
Une chaudière brûle complètement en moyenne tous les jours $7,84m^{3}$ de gaz propane selon équation bilan suivante :
$C_{3}H_{8} + 5O_{2} → 3CO_{2} + 4H_{2}O$
Un élève de la classe de troisième souhaite calculer en litre, le volume du dioxyde de carbone rejeté chaque jour dans l’atmosphère au cours de cette combustion.
Il éprouve des difficultés. Viens-lui-en aide pour répondre aux questions suivantes.
Calculer :
1. la quantité de propane brûlé ;
2. la quantité de dioxyde de carbone rejeté au cours de cette combustion ;
3. le volume de dioxyde de carbone rejeté dans l’atmosphère.
On donne : $1m^{3}= 103L ; V_{m}= 22,4L/mol$
EXERCICE 13
Les automobilistes utilisent les essences comme carburant.
Soit un carburant supposé formé d'heptane pur.
1. Ecrire la formule semi-développée de l'heptane.
2. Ecrire l'équation-bilan de sa combustion complète
3. La densité de l'heptane est $d = 0,68$.
On considère le réservoir d'une automobile contenant $45L$ de carburant.
3.1. Quel volume d'air faut-il pour la combustion complète de toute l'essence contenue dans le réservoir?
3.2. Quel est le volume de dioxyde de carbone rejeté dans l'atmosphère?
N.B : Tous les volumes sont mesurés dans les conditions normales de température et de pression.
4. Le pouvoir calorifique de l'heptane est d'environ $46000kJ/kg$.
Le rendement du moteur de l'automobile est de $25%$.
4.1. Quelle quantité d'énergie est utilisée à la propulsion du véhicule?
4.2. Quelle quantité d'énergie sert à chauffer l'atmosphère lors de la combustion complète de l'essence du réservoir?
On donne : $ρ_{eau} =1000kg.m^{-3}$
EXERCICE 14
On introduit dans un eudiomètre $80cm^{3}$ d'un mélange d'éthane et de propane et $400cm^{3}$ de dioxygène.
Après passage de l'étincelle et retour aux conditions initiales, il reste $255cm^{3}$ d'un mélange gazeux dont $210cm^{3}$ sont absorbés par la potasse et le reste par le phosphore.
1. Quelle est la formule brute de chacun de ces hydrocarbures introduit dans l'eudiomètre?
2. Dans quel état trouve-t-on ces hydrocarbures à la température ordinaire?
3. Pourquoi revenir aux conditions initiales après le passage de l'étincelle?
4. Combien d'isomères présente chacun de ces hydrocarbures?
5. Ecrire les équations-bilan de toutes les réactions chimiques qui ont lieu
6. Déterminer la composition volumique du mélange initial.
EXERCICE 15
La préparation du méthane se fait au laboratoire par une réaction chimique dont l'équation est de la forme : $A + H_{2}O → B + Al(OH)_{3}$
1. Donner le nom et la formule brute du composé $A$
2. Donner le nom, la formule brute et la représentation spatiale du composé $B$
3. Qu'appelle-t-on carbone tétragonal ?
4. La notion de conformation est-elle applicable au méthane?
Pourquoi?
5. Réécrire et équilibrer l'équation bilan ci-dessus.
6. Quel volume de méthane peut-on obtenir à partir de $18g$ de composé $A$.
7. Sachant qu'on a plutôt recueilli à la fin de la réaction, $3,6L$ de méthane à partir de $18g$ du composé
$A$, déterminer le rendement de cette réaction.
8. En déduire le pourcentage d'impuretés initialement présentes dans le composé $A$.
On donne : $V_{m}=22,4L.mol-1; Al=27g.mol^{-1}; O=16g.mol^{-1}; H=1g.mol^{-1}; C=12g.mol^{-1}$
9. Comment devons-nous procéder si nous voulons accélérer cette réaction?
EXERCICE 16
Deux alcanes $A_{1}$ et $A_{2}$ de formule générale $C_{x}H_{y}$, subissant les combustions complète pour l’alcane $A_{1}$ et incomplète pour l’alcane $A_{2}$ en présence du dioxygène.
La combustion complète produit $24,6mL$ de dioxyde de carbone et $35,1mL$ d’eau, alors que dans le cas de la combustion incomplète $25mL$ de carbone et $30mL$ d’eau sont recueillis.
$V_{m} = 22,4 L/mol$.
1. Quelle condition faut-il remplir pour avoir une combustion complète d’une part et une combustion incomplète d’autre part ?
2. Ecrire les équations équilibrées de ces deux combustions des alcanes $A_{1}$ et $A_{2}$.
3. Déterminer les formules brutes de ces deux alcanes en considérant les volumes des alcanes $A_{1}$ et $A_{2}$ sont respectivement $7mL$ et $5mL$.
4. Au regard des formules brutes des alcanes $A_{1}$ et $A_{2}$ sont-ils des isomères ?
Justifier la réponse.
5. Donner toutes les formules sémi-dévéloppées possibles des alcanes $A_{1}$ et $A_{2}$ et nommer-les.
EXERCICE 17
Expérience 1
Le laborantin du lycée voudrait expérimenter la chloration des alcanes qui se trouve dans un flacon dont l’étiquette a été partiellement endommagée.
Afin de d’identifier le produit qu’il va utiliser, il commence par effectuer la combustion dans un excès de dioxygène, de $7,2g$ du contenu du flacon de masse molaire $M=37,03g/mol$, et obtient $10,8%$ d’hydrogène et $32,40%$ en carbone.
Expérience 2
Le laborantin poursuit son expérimentation en mettant en présence de la lumière, du dichlore et un certain volume du contenu dudit flacon.
Il constate une décoloration du dichlore.
La première analyse des produits de cette réaction montre qu’il existe un seul dérivé monochloré.
1. Déterminer la formule brute de ce produit contenu dans le flacon.
Cet alcane n’a qu’une unique formule sémi-développée ? Possède-t-il des isomères de chaîne?
2. Expliqué à quoi renvoi cette décoloration observer dans l’expérience $2$, écrire l’équation de la réaction qui a lieu pour l’obtention du produit révélé par la première analyse et nommer le dit produit.
3. Ecrire les équations de formation des éventuels produits que pourrait révéler une seconde analyse des produits de la réaction de l’expérience $2$ et nommer-les.
4. Proposer au laborantin un schéma annoté avec toute la verrerie possible qui illustre l’expérience
EXERCICE18 Détermination de la formule brute
Les paraffines mélanges d'alcanes, sont des produits visqueux ou cireux, sans odeur, très stables chimiquement.
Ils sont des sous-produits de la distillation du pétrole et trouvent de nombreuses utilisations comme :
fabrication des lubrifiants, produits d'entretien, bougies, enduits inattaquables par les acides, médicament…
Il en existe deux types:
la paraffine liquide qui est une huile minérale composée d’un mélange d’hydrocarbures aliphatiques saturés $(n=14 à 18)$ et les paraffines solides $(n=20 à 40)$.
Les vapeurs de paraffine liquide peuvent avoir des effets légèrement narcotiques et troubles de
l’absorption de vitamines liposolubles.
L’élève Ali de la classe de première $D$, constate que sur une ordonnance prescrite à sa petite sœur de $20$ mois le médecin a prescrit un médicament contenant de la paraffine.
Il décide alors d’aider son père à connaitre le type de paraffine prescrit.
Pour cela il fait une analyse quantitative qui lui révèle la composition suivante :$ C=84,84% ; H=15,15%$.
1. Identifier ce qui empêche Ali de retrouver la formule brute de ce médicament.
2. Retrouver la formule liant la masse molaire $M$ du composé au nombre $n$ d’atomes de carbone que possède la chaine carbonée.
3. A l’aide vos connaissances, retrouver la formule brute du médicament ainsi que son type (classe de paraffine) sachant qu’Ali a lu sur l’ordonnance paraffine $198g/mol$.
EXERCICE 19
Un hydrocarbure aliphatique saturé $(A)$ a une masse molaire moléculaire $M = 58 g.mol^{-1}$.
1.1. Trouver la formule brute de $(A)$.
1.2. Ecrire les formules semi développées possibles et donner le nom des différents isomères de $(A)$.
1.3. Identifier par son nom le composé $(A_{1})$ sachant qu’il présente une chaîne ramifiée.
2. L’action du dibrome sur l’hydrocarbure $(A_{1})$ en présence de lumière riche en $U.V$ donne un mélange de dérivés bromés dont l’un est un dérivé dibromé noté $(B)$.
2.1. Ecrire l’équation chimique de la réaction conduisant à la formation de $(B)$ en utilisant les formules brutes.
2.2. Donner les formules semi-développées possibles de $(B)$ et le nom des isomères correspondants.
2.3. La structure de l’hydrocarbure de départ $(A_{1})$ a-t-elle été modifiée au cours de cette réaction ?
3. L’un des isomères $(B_{1})$ de $(B)$ peut être obtenu par réaction d’addition du dibrome sur un alcène.
3.1. Trouver la formule brute de cet alcène.
3.2. Ecrire la formule semi-développée et le nom de cet alcène.
3.3. Ecrire l’équation de la réaction d’addition en utilisant les formules brutes.
3.4. La structure de l’hydrocarbure de départ a-t-elle été modifiée au cours de cette réaction ?
EXERCICE 20
Un hydrocarbure aliphatique saturé $(A)$ de formule brute $C_{n}H_{2n+2}$ réagit avec du dibrome.
On obtient un composé $(B)$ disubstitué renfermant $79,2%$ en masse de brome.
1. Ecrire l’équation chimique de la réaction de substitution.
2. Déterminer le nombre n d’atomes de carbone contenu dans cet hydrocarbure $(A)$.
3. En déduire les formules brutes de $(A)$ et de $(B)$.
4. Ecrire les formules semi-développées et les noms des isomères possibles de $(B)$.
5. Un des isomères de $(B)$ noté $(B_{1})$ est obtenu par addition du dibrome sur un hydrocarbure aliphatique insaturé $(C)$.
5.1. Ecrire la formule semi-développée de $(B_{1})$.
5.2. En déduire la formule semi-développée et le nom de $(C)$.
5.3. Ecrire l’équation chimique de la réaction d’addition donnant $(B_{1})$
EXERCICE 21 Mélange carburant - air
On désire étudier la richesse du mélange « carburant- air » admis dans un cylindre d’un moteur thermique.
La richesse de ce mélange est caractérisée par un coefficient noté $K$ :
Si $K< l$, on dit que le mélange est riche.
Si $K>$1, on dit que le mélange est pauvre.
On admettra que le carburant utilisé est principalement constitué d'octane de formule brute $C_{8}H_{18}$.
Dans les conditions du fonctionnement étudié,
- le volume d'un cylindre du moteur est de $400cm^{3}$
- la masse de carburant à l’état gazeux injectée par cylindre et par admission est de $22,8mg$
- le volume molaire gazeux est de $30L.mol^{-1}$
l. A quelle famille d’hydrocarbures l’octane appartient-il ?
Justifier.
2. Ecrire et équilibrer l’équation bilan de la combustion complète de 1‘octane.
3. Calculer la quantité de dioxygène $n(O_{2})$, exprimée en moles admise dans un cylindre pour assurer une combustion dans les conditions stœchiométriques.
4. En déduire le volume de dioxygène $V(O_{2})$, et le volume d'air Vair correspondants.
Rappel : l'air comporte$ 20% $de dioxygène en volume.
5. Le coefficient $K$, sans unité, est alors défini par le rapport : où $V$ est le volume d'un cylindre du moteur et $V_{0}$ le volume d’air nécessaire à la combustion du carburant dans les conditions stœchiométriques dans un cylindre.
Ces deux volumes sont pris dans les mêmes conditions de température et de pression.
Déterminer $K$, au centième près, dans ces conditions.
6. Le mélange est-il riche ou pauvre ?
Justifier
EXERCICE 22 (Monochloration d’alcanes)
Trois alcanes ont la même masse molaire : $72g.mol^{-1}$
1. Déterminer la formule brute de ces trois alcanes
2. Donner les formules sémi-dévéloppées de ces trois alcanes notés $A, B$ et $C$.
Puis les nommer
3. On désire identifier ces trois alcanes.
Pour cela, on procède à leur monochloration et on obtient les résultats suivants :
- $A$ donne $3$ dérivés monochlorés $D, E$ et $F$
- $B$ donne $4$ dérivés monochlorés $G, H, I$ et $J$
- $C$ donne 1dérivé monochloré $K$
Identifier $A, B$ et $C$
1. 4. Donner les formules sémi-développées de tous les dérivés monochlorés notés $D, E, F, G, H, I, J$ et $K$.
Les nommer.
EXERCICE 23
1. La combustion de$ 7,2g$ d'un alcane donne $10,8g$ d'eau.
1. Déterminer la formule brute de l'alcane ainsi que ses formules semi-développées possibles en précisant les noms.
1.2. Ecrire l'équation de cette combustion.
1.3. Calculer le volume d'air nécessaire pour cette combustion, ainsi que le volume de $CO_{2}$ obtenu.
Les volumes sont mesurés dans les $CNTP$.
2. Un carbure d'hydrogène de formule $C_{n}H_{2n+2}$ a une masse molaire $M = 30g.mol^{-1}$
2.1. Donner sa formule brute
2.2. On remplace $x$ atomes d'hydrogène de cet hydrocarbure par $x$ atomes de chlore
2.2.1. Calculer $x$ sachant que le dérivé chloré a une masse molaire moléculaire égale à $99g/mol$
2.2.2. Donner les formules développées et les noms des différents isomères possibles du dérivé chloré. On donne : $Cl = 35,5g/mol$
