ELECTROLYSE- BILAN QUANTITATIF
EXERCICE 1
On réalise l'électrolyse d'une solution aqueuse de bromure de cuivre $(II)$ avec des électrodes inattaquables en graphite.
On observe un dépôt rougeâtre à l'une des électrodes. Les seuls couples redox mis en jeu lors de cette électrolyse sont : $Cu^{2+} / Cu$ et $Br_{2} /Br^{-}$.
1. Quelles sont les entités chimiques initialement présentes en solution ?
2. Préciser sur un schéma le sens de déplacements des porteurs de charges.
3. Identifier le dépôt rougeâtre. Sur quelle électrode a lieu ce dépôt ?
4. Écrire la demi-équation de la transformation qui a lieu à l'autre électrode ?
5. Ecrire l'équation chimique de la réaction d'oxydoréduction qui se produit pendant l'électrolyse. S'agit-il d'une réaction spontanée ?
EXERCICE 2
On réalise l’électrolyse d’une solution aqueuse de bromure de cuivre $(Cu^{2+}(aq) ; 2Br^{-} (aq))$ dans un tube en $U$.
Les électrodes sont en graphite et inattaquables.
1. Faire l'inventaire des espèces chimiques présentes dans l'électrolyseur et prévoir les réactions qui peuvent se produire à chacune des électrodes ?
2. On observe un dépôt métallique orange-rosé sur une électrode.
A l’autre borne, la solution devient brune.
2.1. Donner la nature des électrodes, les réactions qui s’y déroulent, et la réaction de l’électrolyse.
2.2. Déterminer la d.d.p. théorique minimale qu'il faut appliquer pour réaliser cette électrolyse.
2.3. Calculer la masse du dépôt orange-rosé obtenu au bout de $30 min$ sous un courant de $0,40 A$.
EXERCICE 3
On effectue l'électrolyse d'une solution aqueuse de chlorure de cuivre $(II) CuCl_{2}$ avec deux électrodes inattaquables en graphite.
Il se dépose du cuivre métallique à la cathode et il se forme du dichlore $Cl_{2}$ à l'anode.
L'électrolyse est effectuée en maintenant l'intensité du courant $I$ constante égale à $2 A$.
1. Préciser les couples redox qui interviennent au cours de l'électrolyse.
2. Ecrire les demi-équations des transformations s'effectuant aux électrodes.
3. En déduire l'équation chimique de la réaction d'oxydoréduction qui se produit pendant cette électrolyse.
4. Déterminer la masse m du métal cuivre et le volume V du dichlore obtenu après une heure d'électrolyse.
EXERCICE 4
On désire faire l’électrolyse d’une solution aqueuse de chlorure de cuivre $II$ en utilisant une électrode inerte de graphite $(Cs)$ comme anode et une électrode de cuivre $Cu$ comme cathode.
1. Faire un schéma du montage
1.1. En précisant où se trouve l’anode et la cathode
1.2. En indiquant le sens du courant et celui du déplacement des électrons.
2. Ecrire les demi-équations au niveau de chaque électrode, ainsi que l’équation bilan de l’électrolyse.
3. Au bout de $10$ minutes de fonctionnement de l’électrolyseur, le dépôt de cuivre a pour masse $635mg$.
3.1. Quelle quantité de matière d’ions cuivre II ont été transformés en métal cuivre ?
3.2. Déterminer le volume de dichlore gazeux dégagé. (Volume molaire $V_{m} = 22,4 L.mol^{-1}$)
4. Calculer l’intensité du courant qui circule dans les fils de jonction.
EXERCICE 5
On dispose :
- d’un générateur de courant continu
- d’un récipient contenant une solution de sulfate de cuivre $II$
- de deux électrodes : l’une en fer et l’autre en cuivre
- de fils conducteurs
1. Préciser ce qui se passe à chaque électrode.
(La galvanoplastie est le dépôt de cuivre sur le fer)
2. Faire le schéma de ce montage en précisant les polarités du générateur.
3. Compléter le schéma en précisant : anode, cathode, oxydation et réduction
EXERCICE 6
Un élément d’accumulateur au plomb est constitué d’une plaque positive dont la grille en plomb $Pb$ est remplie d’une pâte d’oxyde de plomb $PbO_{2}$ et d’une plaque négative dont la grille au plomb est remplie de pâte de plomb.
L’électrolyte est l’acide sulfurique $H_{2}SO_{4}$.
1. Ecrire le symbole de cet élément d’accumulateur et calculer sa $f.é.m$.
2. Sachant qu’un accumulateur est formé de $6$ éléments montés, calculer sa f.é.m.
3. Ecrire l’équation bilan de la réaction d’oxydoréduction lorsque l’accumulateur débite, il fonctionne alors en générateur.
4. Calculer les variations de masse de plomb et d’oxyde de plomb lorsque
l’accumulateur débite un courant d’intensité $I= 80A$ pendant $10s$.
5. Calculer la quantité de matière d’ions hydrogène H+ qui ont réagi.
En déduire la masse d’acide utilisée.
6. Un accumulateur peut être rechargé. Il fonctionne alors en électrolyseur.
Il suffit de le brancher en opposition avec un générateur de courant continu de $f.é.m. > 12V$.
Ecrire l’équation bilan de la réaction de la réaction d’oxydoréduction.
EXERCICE 7
Une pompe immergée de forage est suspendue au bout d’un câble d’acier (alliage à base de fer) dans un tube de fer de $100,0 mm$ de diamètre intérieur et de $3,0 mm$ d’épaisseur.
La surface de l’eau est à environ $2$ à $3m$ au-dessus de la pompe.
Le propriétaire craignant une cassure du câble par corrosion et la perte de sa pompe imagine la solution suivante : « il relie le câble et le tube par un générateur de tension continue qui fournit alors un courant d’intensité $I = 5,0 mA$, dans le circuit constitué par ces éléments et l’eau du forage ».
1.1. Ecrire la demi-équation électronique correspondant au couple $Fe^{2+} / Fe$.
1.2. A quel type de réaction appartient-elle ?
1.3. Préciser le sens de la demi-équation correspondant à la corrosion du fer.
L’acier du câble et le tube de fer du tube sont susceptibles de subir cette réaction, mais dans cette application particulière, c’est le tube qui devra assurer la protection du câble.
2.1. Sur un schéma du circuit où câble et tube seront simplement représentés par des électrodes, indiquer la borne du générateur qui doit être reliée au tube pour que le câble ne subisse pas la corrosion.
Justifier.
2.2. On indiquera aussi l’anode, la cathode, le sens de circulation des électrons et du courant.
2.3. Comment appelle-t-on ce type de protection ?
3.1. Calculer la quantité d’électricité transportée au bout d’un an.
En déduire la masse de fer qui aura alors disparu sur le tube.
3.2. Comparer à la masse d’un mètre linéaire de tube.
Données :
$1F ≈ 96500 C.mol^{-1} ; ρfer = 7,8.103 kg.m^{-3}$ ; durée d’un an : 3,15.107s
EXERCICE 8
Certaines toxines présentes dans le sang peuvent oxyder les ions fer (II) en ion fer (III) et empêcher la fixation du dioxygène.
1. Déterminer le nombre d’oxydation de l’élément fer dans les deux ions.
2. En déduire le couple redox associé.
Au laboratoire, l’oxydation des ions fer $(II)$ peut aussi être réalisée avec l’ion permanganate $MnO_{4-}$
L’ion permanganate $MnO_{4-}$ et l’ion manganèse $Mn_{2+}$ forme un couple redox.
3. Sachant que le nombre d’oxydation de l’élément Oxygène est de $-2$, déterminer le nombre d’oxydation de l’élément manganèse dans les deux cas.
4. En déduire le couple redox associé.
5. Écrire l’équation de demi-réaction en solution aqueuse du couple avec l’élément fer.
6. Écrire l’équation de demi-réaction en milieu acide du couple avec l’élément manganèse.
7. En déduire l’équation de réaction d’oxydo-réduction en milieu acide.
EXERCICE 9
Les fils d'aluminium utilisés comme conducteurs électriques sont recouverts de nickel Ni afin d'éviter la formation d'une couche d'alumine isolante qui peut engendrer des problèmes de contact.
Pour le nickelage de ces fils, on plonge le fil d'aluminium et une tige de nickel qui jouent tous les deux le rôle d'électrodes dans un bain électrolytique contenant l'ion nickel $Ni^{2+}$.
Soit un fil d'aluminium de longueur $L = 300 m$ et de diamètre $d = 2,0 mm$ qu'on désire recouvrir d'une couche de nickel d'épaisseur $e = 1,5μm$ par électrolyse pendant une durée $Δt = 1min$.
1. Le fil d'aluminium à nickeler joue-t-il le rôle d'anode ou de cathode ?
2. Ecrire les équations chimiques des transformations aux électrodes.
3. Calculer la masse m de nickel déposée en une minute.
4. Calculer l'intensité du courant électrique $I$ nécessaire à un tel dépôt.
Données : la masse volumique du nickel $ρNi$ est égale à $8,9.103 kg.m^{-3}$; la masse molaire atomique du nickel est égale à $58,7g.mol^{-1}$
EXERCICE 10
Les accumulateurs cadmium-nickel sont très utilisés en électronique portable.
Ils font intervenir les couples $Cd(OH)2/Cd$ et $NiOOH/Ni(OH)2$.
Au sein de l'accumulateur la réaction spontanée est celle qui met en jeu les réactifs cadmium $Cd$ et $NiOOH$.
1. Ecrire les demi-équations des transformations aux électrodes et l'équation chimique de la réaction qui se produit pendant la charge.
Dans ce cas l'accumulateur joue-t-il le rôle de pile ou d'électrolyseur ?
2. Ecrire les demi-équations des transformations aux électrodes et l'équation chimique de la réaction qui se produit pendant la décharge.
Dans ce cas l'accumulateur joue-t-il le rôle de pile ou d'électrolyseur
EXERCICE 11
Par le procédé d'électrolyse à anode soluble, on souhaite purifier une barre de $15g$ de cuivre dont le pourcentage massique des impuretés est de $2,0 %$.
1. Donner le principe de ce procédé.
2. Ecrire les demi-équations des transformations s'effectuant aux électrodes.
3. Déterminer la durée de l'électrolyse pour une intensité de courant constante égale à $2,0 A$
EXERCICE 12
On veut déposer par électrolyse à anode soluble une couche d'argent d'épaisseur $50μm$ sur une cuillère dont l'aire de la surface est égale à $100 cm^{2}$.
1. Comment faut-il procéder ?
2. Ecrire les demi-équations des transformations aux électrodes.
3. Calculer la masse d'argent à déposer sur la cuillère.
4. Déterminer la durée de l'opération d'argenture sachant que l'intensité du courant est maintenue constante et égale à $10,0 A$ durant l'électrolyse.
Donnée : masse volumique de l'argent $ρ_{Ag} =10,5 g.cm^{-3}$.
EXERCICE 13
On dépose par électrolyse du nickel métallique sur un objet en fer.
L'électrolyse est réalisée à partir d'une solution de sulfate de nickel$ (II)$ en utilisant l'objet à recouvrir et du graphite comme électrodes.
A l'électrode en graphite on observe un dégagement gazeux de dioxygène résultant de l'oxydation de l'eau.
1. L'objet en fer doit-il constituer la cathode ou l'anode?
2. Ecrire les demi-équations électroniques des réactions aux électrodes ainsi que l'équation de la réaction bilan de l'électrolyse.
3. Déterminer la masse de nickel déposée sur l'objet en fer après $45$ minutes d'électrolyse sous une intensité constante de $1,8 A$.
4. Déterminer le volume de dioxygène dégagé.
EXERCICE 14
Le recouvrement des plaques d'acier d'une couche de zinc par électrolyse permet de les protéger contre la corrosion.
La protection est jugée efficace lorsqu'on aura déposé $40,0 g$ de zinc par mètre carré de plaque d'acier.
On réalise l'électrolyse à partir d'une solution de sulfate de zinc $(II) ZnSO_{4}$ de concentration molaire égale à $0,5 mol.L^{-1}$ et de volume $100L$.
L'intensité du courant est maintenue constante égale à 100 $A$.
1. Déterminer la durée nécessaire pour recouvrir $5$ plaques de $0,35 m^{2}$ de surface chacune.
2. Calculer la concentration finale du bain d'électrolyse
EXERCICE 15
L’électrolyse est utilisée pour recouvrir les métaux avec une couche mince d’un autre métal, comme le zingage ou l’argenture…, pour les protéger de la corrosion ou pour améliorer son aspect.
Données :
$ρ_{Ag}=10,5g.cm^{-3} ; M_{Ag}=108g.mol^{-1} ; V_{M}=25L.mol^{-1} ; 1F=9,65.103C.mol^{-1}$
On veut argenter une assiette métallique de surface totale $S= 190,5 cm²$ en couvrant sa surface avec une couche mince d’argent de masse $m$ et d’épaisseur $e= 20µm$.
Pour atteindre cet objectif, on réalise une électrolyse dont l’assiette constitue l’une des électrodes.
La deuxième électrode est une tige en platine inattaquable dans les conditions de l’expérience.
L’électrolyte utilisé est une solution aqueuse de nitrate d’argent $(Ag^{+}, NO_{3^{-}} )$ de volume $V= 200 mL$ ( voir la figure ) .
1. L’assiette doit être l’anode ou la cathode ?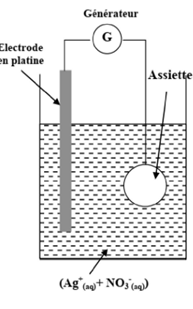
2. Ecrire l’équation bilan de l’électrolyse.
3. Calculer la masse m de la couche d’épaisseur e déposée sur la surface de l’assiette.
4. Quelle est la concentration molaire initiale minimale $[Ag^{+} ]$ nécessaire de la solution de nitrate d’argent ?
5. L’électrolyse a lieu pendant une durée $\delta t =30,0min$ avec un courant d’intensité constante $I$.
5.1. Etablir l’expression de l’intensité du courant $I$ en fonction de $m M(Ag), F$ et $\delta t$
5.2. Calculer la valeur de $I$
5.3. Calculer le volume $V(O_{2})$ du dioxygène formé pendant $\delta t$.
EXERCICE 16
On réalise l’électrolyse d’une solution aqueuse de nitrate de plomb $(Pb^{2+}(aq) ; 2NO_{3^{-}(aq))$.
Les électrodes sont inattaquables et les ions nitrate ne réagissent pas.
1. Il se forme un dépôt de plomb sur une électrode
- Quelle est cette électrode ?
Ecrire l’équation de la réaction correspondant à ce dépôt
2. Sur l’autre électrode, se dégage un gaz qui ravive une allumette incandescente.
- De quel gaz s’agit-il ? Sur quelle électrode se forme-t-il ?
Ecrire l’équation de la réaction correspondant à ce dégagement.
3. En déduire l’équation de la réaction globale ayant lieu au cours de cette électrolyse.
4. L’électrolyse dure $25min$ et l’intensité du courant est maintenue égale à $0,85 A$
4.1. Quelle est la quantité de plomb qui se dépose sur l’une des électrodes ?
En déduire la masse de plomb déposé.
4.2. Déterminer le volume de gaz qui s’est formé sur l’autre électrode ; le volume molaire des gaz est pris à $25 L.mol^{-1}$
EXERCICE 17
On désire réaliser un dépôt de nickel sur un objet en fer. Pour cela, on réalise l'électrolyse d'une solution de sulfate de nickel $(Ni^{2+} ; SO_{4^{2-}})$.
L'objet à recouvrir constitue l'une des électrodes. L'autre électrode est inattaquable : on y observe un dégagement gazeux de dioxygène.
1. L'objet en fer doit-il constituer la cathode ou l'anode ? Représenter sur un schéma les branchements
à réaliser.
2. Écrire les demi-équations électroniques des réactions aux électrodes ainsi que l'équation bilan de l'électrolyse.
3. Quelle est la masse de nickel déposée sur l'objet en fer après $45$ minutes d'électrolyse sous une intensité de $1,8 A$?
4. En réalité, le dépôt ne nickel fait $0,95 g$.
Calculer le rendement de l’électrolyse
5. Quelle est alors la masse de dioxygène produite ?
EXERCICE 18
Pour argenter un objet métallique, on le place dans une solution de nitrate d’argent $(Ag+; NO_{3^{-}})$ où il joue le rôle d’une des électrodes ; l’autre est en argent
1. Pourquoi appelle-t-on ce genre d’électrolyse « électrolyse à anode soluble » ?
2. L'objet doit-il constituer la cathode ou l'anode? Représenter sur un schéma les branchements à réaliser.
3. Écrire les demi-équations électroniques des réactions aux électrodes ainsi que l'équation bilan de l'électrolyse.
4. On souhaite déposer une masse égale à $3,00 g$ d’argent sur l’objet.
L’intensité du courant électrique utilisé pour l’électrolyse est de 650 mA.
- Calculer la durée de l’électrolyse
5. En fait le rendement de l’électrolyse est de $75 %$ ; quel sera la véritable durée de l’électrolyse ?
EXERCICE 19
Certains métaux sont préparés par électrolyse d’une solution aqueuse les contenant à l’état de cations.
Plus de $50 %$ de la production mondiale de zinc sont obtenus par électrolyse d’une solution de sulfate de zinc acidifiée à l’acide sulfurique.
Les ions sulfate ne participent pas aux réactions électrochimiques.
On observe un dépôt métallique sur l’une des électrodes et un dégagement gazeux sur l’autre.
L’électrolyse a lieu sous $3,5 V$.
l’intensité du courant peut atteindre $80 kA$.
Après $48 h$ de fonctionnement, le dépôt de zinc est suffisamment épais.
Il est alors séparé de l’électrode, fondu et coulé en lingots.
1. Quelles sont les réactions susceptibles de se produire sur chaque électrode sachant que c’est le solvant qui est oxydé en dioxygène ?
Donner l’équation de la réaction d’électrolyse
2. Schématiser l’électrolyseur, en précisant le nom de chaque électrode, leur polarité et le sens de déplacement des espèces chargées.
3. S’agit-il d’une transformation spontanée ou forcée ? Pourquoi ?
4. Quelle est l’ordre de grandeur de la masse de zinc produite par une cellule en deux jours ?
5. En fait, on obtient une quantité de zinc inférieure à celle attendue de 3,76 tonnes. Calculer le rendement de la réaction
6. A l’autre électrode on récupère le dioxygène.
Le rendement de la réaction qui le produit est de $80 %$ et le volume molaire est de $24 L·mol^{-1}$.
- Quel est l’ordre de grandeur du volume de dioxygène qui se dégage ?
EXERCICE 20
On réalise l’électrolyse d’une solution de chlorure de sodium $(Na^{+} ; Cl^{-})$ sous une tension de $3,8V$ et une intensité de $45 kA$.
On observe un dégagement de dichlore à l’anode et un dégagement de dihydrogène à la cathode, et l’apparition d’ions $OH^{-}$ (le milieu devient basique).
1. Écrire l’équation de la réaction globale qui a lieu lors de cette électrolyse.
2. Introduire les ions indifférents Na+ dans l’équation précédente, afin de montrer qu’il se forme de la soude
3. Calculer la masse de dichlore produite en 1 jour
4. Calculer la masse de dihydrogène produite en 1 jour
5. Quelles masses de chlorure de sodium et d’eau sont consommés quotidiennement ?
