CLASSIFICATION QUALITATIVE DES COUPLES ION METALLIQUE/ METAL
EXERCICE 1
Lorsqu’on plonge une lame d’étain $S_{n}$ dans une solution contenant des ions $Pb^{2+}$, elle se couvre de plomb et il se forme des ions $Sn^{2+}$.
Lorsqu’on plonge une lame d’aluminium dans une solution contenant des ions $S_{n^{2+}}$, elle se couvre d’étain et il se forme des ions aluminium $Al^{3+}$.
1. Ecrire les équations chimiques des réactions observées.
2. Proposer une classification électrochimique pour les métaux $Al, Sn$ et $Pb$ selon leur pouvoir réducteur décroissant.
3. Préciser ce que l’on observe lorsqu’on plonge une lame de plomb dans une solution contenant des ions aluminium $Al^{3+}$.
EXERCICE 2
On donne la classification électrochimique suivante:

On réalise les deux expériences suivantes :
Expérience $n°1$ : On plonge une lame de fer dans une solution verte de sulfate de nickel $(II) NiSO_{4}$.
Quelques instants plus tard on observe la formation d’un dépôt métallique.
Expérience $n°2$ : On plonge une lame de plomb dans une solution de sulfate de nickel $(II)$ ; aucun dépôt n’apparaît.
1. Ecrire l’équation bilan de la réaction qui a lieu lors de la première expérience.
2. Montrer que ces deux expériences permettent de prévoir la place du nickel dans la classification proposée.
EXERCICE 3
1. Au cours d’une expérience, un groupe d’élèves note les observations suivantes :
- une lame d’argent plongée dans une solution de chlorure d’or $(AuCl_{3}) $se recouvre d’or.
- une lame de cuivre plongée dans une solution de nitrate d’argent $(AgNO_{3)$ se recouvre d’argent.
- une lame de fer pongée dans une solution de sulfate de cuivre $(II)$ se recouvre de cuivre.
1.1. Interpréter ces différents résultats.
1.2. En déduire une classification suivant le pouvoir réducteur croissant des couples ion métallique/métal mis en jeu au cours de cette expérience.
1.3. Sachant que l’acide chlorhydrique attaque le fer et non le cuivre, placer le couple $H^{+}/H_{2}$ dans la classification précédente.
2. On verse dans un bêcher une petite quantité d’une solution de nitrate d’argent et on y fait barboter du dihydrogène.
Il apparaît de l’argent finement divisé, noir.
2.1. Ecrire l’équation bilan de la réaction d’oxydoréduction qui s’est produite.
2.2. Préciser les espèces oxydée et réduite.
3. Sachant que le dihydrogène a été préparé par action de l’acide chlorhydrique sur le zinc avec un rendement de $100%$ et que seulement $10%$ du dihydrogène formé réagissent avec le nitrate d’argent le reste s’échappe), quelle masse d’argent peut-on obtenir si on consomme $4g$ de zinc ?
EXERCICE 4
La soudure utilisée par les plombiers est un alliage de plomb $Pb$ et d'étain $S_{n}$.
Le pourcentage massique en étain est de $25 %$.
Cette soudure est attaquée par les solutions aqueuses d'acide chlorhydrique et d’acide sulfurique.
1. Préciser les couples redox mis en jeu au cours de l’attaque acide de la soudure.
2. Ecrire quand cela est possible l’équation chimique de la réaction redox.
3. Calculer la masse de soudure attaquée par $50 mL$ d'une solution d'acide chlorhydrique de concentration égale à $2 mol.L^{-1}$.
4. Calculer le volume de dihydrogène dégagé mesuré dans les conditions où le volume molaire des gaz est égal à $22,4L.mol^{-1}$.
EXERCICE 5
Indiquer dans chaque cas s’il y a réaction entre la lame de métal et l’ion métallique de la solution ionique et, s’il y a réaction, écrire l’équation bilan :
1. Lame de zinc $Zn$ et sulfate de cuivre $II (Cu^{2+}+ SOSO_{4}^{2-})$
2. Lame de fer $Fe$ et nitrate d’argent $(Ag^{+}+NO_{3^{-}}) $
3. Lame de fer $Fe$ et sulfate d’aluminium $(2Al^{3+}+3SOSO_{4}^{2-})$
4 Lame de cuivre $Cu$ et chlorure d’or $(Au^{3+}+3Cl^{-}) $
5. Lame de platine $Pt$ et chlorure de zinc $(Zn^{2+}+2Cl^{-})$
6. Lame de zinc $Zn$ et chlorure de plomb (Pb^{2+}+2Cl^{-})$
7. Lame de cuivre $Cu$ et sulfate de fer $II (Fe^{2+}+SO_{4}^{2-})$
EXERCICE 6 Séparation d’ions métalliques
On dispose d’une solution $S$ contenant comme cations $Ag^{+}, Pb^{2+}, Al^{3+}$
Afin de séparer ces cations on utilise un dispositif comportant 2 filtres :
Sur le 1er filtre, on a disposé de la poudre de cuivre métallique et sur le 2ème de la poudre de zinc métallique.
La solution S est versée sur le 1er filtre : il se forme un dépôt solide.
Le filtrat et les eaux de récupération passent alors sur le 2ème filtre : il se dépose un autre solide.
On traite la solution récupérée par une solution d’hydroxyde de sodium puis par une solution d’ammoniaque concentrée.
On recueille un précipité que l’on sépare du filtrat par simple filtration.
1. Redessiner l’axe et entourer les espèces chimiques présentes lors du passage sur le 1er filtre.
2. En déduire l’équation de la réaction d’oxydoréduction qui a lieu.
3. Quel métal recueille-t-on sur le premier filtre ?
Quel ion a-t-on alors « éliminé » de la solution S ?
Que contient alors le filtrat ?
4. Répondre aux mêmes questions pour le passage sur le 2ème filtre des eaux de récupération et du filtrat.
5. Les ions zinc et les ions aluminium forment un précipité avec les ions hydroxyde.
Le précipité d’hydroxyde de zinc se redissout en présence d’ammoniaque mais pas le précipité d’hydroxyde d’aluminium.
Quels sont les cations métalliques encore présents dans le filtrat en fin de traitement ?
Données : Classement des couples en fonction de leur pouvoir oxydant
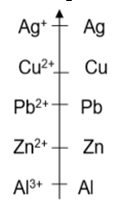
EXERCICE 7
1. On réalise les expériences suivantes:
- une lame d’argent plongée dans une solution de chlorure d’or $(AuCl_{3})$ se recouvre d’or.
- une lame de cuivre plongée dans une solution de nitrate d’argent$(AgNO_{3})$ se recouvre d’argent.
- une lame de fer plongée dans une solution de sulfate de cuivre $II (CuSO_{4})$ se recouvre de cuivre.
1.1. Interpréter ces différentes réactions et en déduire une classification qualitative des couples $Ag^{+}/Ag,
Cu^{2+}/Cu, Au^{3+}/Au, Fe^{2+}/Fe$ suivant le pouvoir oxydant croissant.
1.2. Sachant que l’acide chlorhydrique dilué attaque le fer et non le cuivre, placer le couple H3O+/H2 dans la classification précédente.
2. On verse dans un bécher un peu de solution de nitrate d’argent et on y fait barboter du dihydrogène.
Peu à peu, il apparait de l’argent finement divisé noir.
2.1. Ecrire l’équation-bilan de la réaction d’oxydoréduction qui s’est produite.
2.2. Sachant que l’hydrogène a été préparé par action de l’acide chlorhydrique sur le zinc, avec un rendement de $100%$ et que seulement $10%$ du dihydrogène formé réagit avec le nitrate d’argent, (le reste s’échappe), quelle masse d’argent peut-on obtenir si on a consommé 4g de zinc ?
EXERCICE 8
1. On veut préparer 500mL d’une solution aqueuse S de sulfate de cuivre $(Cu^{2+}, SO4_{2^{-}})$ de concentration molaire volumique $C = 0,1mol/L$.
Déterminer la masse de sulfate de cuivre sec qu’il faut utiliser.
2. A partir de la solution $S$, on prépare $V’ = 100mL$ d’une solution diluée $S’$ de sulfate de cuivre de concentration $C’ = 2,0.10^{-2}mol/L$.
Déterminer le volume de la solution $S$ qu’il faut prélever pour préparer cette solution $S’$.
3. On verse les $100mL$ de la solution $S’$ dans un bécher et on plonge dans cette solution une lame de plomb.
On constate :
- la formation de cuivre métallique sur la lame de plomb ;
-la décoloration progressive de la solution ;
-une diminution de la masse de la lame de plomb.
3.1. Déduire de ces observations, la réaction qui s’est produit et écrire son équation-bilan.
3.2. Quelle masse de plomb a été consommée quand la solution est totalement décolorée ?
4. On récupère la lame de plomb que l’on débarrasse du dépôt de cuivre. Ensuite cette lame est plongée dans une solution de chlorure d’aluminium $(Al^{3+}, 3Cl^{-})$.
Aucun changement n’est alors observé.
A partir de cette expérience et celle de la question $3$, classer les couples $Cu^{2+}/Cu ; Pb2+^{2+}/Pb et Al^{3+}/Al$ par ordre de pouvoir oxydant croissant $(P.O.C)$ et de pouvoir réducteur croissant $(P.R.C)$.
EXERCICE 9
1. On plonge une lame de zinc dans 50 mL d'une solution de sulfate de cuivre de concentration $0,02 mol.L^{-1}$.
$Zn = 65,4 ; Cu = 63.5 ; Ag=108 g.mol^{-1}$
1.1. Qu'observe-t-on ? Ecrire l'équation bilan de la réaction
1.2. Quelle est la masse de zinc qui a été oxydée ?
1.3. Quelle est la masse du dépôt métallique ?
2. De la tournure de cuivre est immergée dans $200mL$ d'une solution de nitrate d'argent de concentration $5*10^{-3} mol.L^{-1}$
Un dépôt métallique se forme ; sa masse est de $45mg$.
2.1. Ecrire l'équation bilan de la réaction ?
2.2. La réaction est-elle totale ? Si elle ne l'est pas calculer la concentration des ions dans la solution à la fin de l'expérience.
2.3. Vérifier que la solution est électriquement neutre
EXERCICE 10
Un clou en fer de masse $m=6,72g$ est plongé dans un volume $Va=80mL$ d’une solution diluée d’acide sulfurique de concentration $Ca=1,5mol.L^{-1}$
La réaction terminée, on ajoute dans la solution un peu de solution d’hydroxyde de sodium, un précipité apparait
1. Quelle est la nature de ce précipité ?
2. Ecrire l’équation-bilan de la réaction de précipitation
3. Ecrire l’équation-bilan de la réaction d’oxydoréduction entre le fer et les ions hydronium de la solution d’acide sulfurique
4. Calculer le volume de gaz dégagé si, dans les conditions de l’expérience, une mole de gaz occupe un volume de $24L$
EXERCICE 11
Une poudre métallique finement broyée de masse $m = 16,5 g$ contient du zinc, du cuivre et de l'aluminium de masses respectives $m_{1}, m_{2}$ et $m_{3}$.
Cette poudre est attaquée par un excès d'une solution d'acide chlorhydrique. Après réaction il reste un résidu solide de masse égale à $3,5g$ et le gaz dégagé occupe dans les conditions de l'expérience un volume $V = 11,2L$.
1. Utiliser la classification électrochimique pour identifier le résidu et les métaux qui passent en solution et leurs cations correspondants.
2. Ecrire les équations bilans des réactions redox qui ont eu lieu.
3. Calculer les masses $m_{1}, m_{2}$ et $m_{3}$.
4. En déduire la composition centésimale massique de la poudre métallique
Données :
- Les couples redox à considérer sont: $Cu^{2+} /Cu, Zn^{2+} /Zn $ et$ Al^{3+} /Al$.
- Les masses molaires atomiques en $g.mol^{-1}$ sont : M(Zn) = 65,4 et $M(Al) = 27$.
- Dans les conditions de l'expérience le volume molaire des gaz est égal à $22,4L.mol^{-1}$
EXERCICE 12
1. On plonge un ruban de magnésium décapé dans une solution de chlorure de cuivre $II (CuCl_{2})$
Observe-t-on une réaction ?
Justifier Si oui :
1.1. Ecrire les couples en présence
1.2. Ecrire les demi-équations électroniques et l’équation bilan
2. On introduit un clou en fer dans une solution de nitrate d’argent $(Ag^{+}, NO_{3^{-}})$
2.1. Qu’observe-t-on ?
2.2. Ecrire les demi-équations électronique
2.3. Quelle espèce chimique subit l’oxydation ?
Quelle espèce chimique subit la réduction ?
3. Qu’observe-t-on quand on introduit une tige de cuivre dans une solution contenant de l’or ?
Qu’observe-t-on quand on introduit un fil d’argent dans une solution contenant du fer $II$
4. On dispose du matériel suivant : 2 béchers , des électrodes de cuivre , fer , zinc , magnésium , des solution de sulfate de cuivre , sulfate de fer , chlorure de zinc , sulfate d’aluminium , chlorure de magnésium , et un pont salin
4.1. Relever les couples oxydo-réducteurs qui concernent les métaux utilisés
4.2. Proposer des piles réalisables
EXERCICE 13
1. Soient les couples redox suivants: $Fe^{2+}/Fe; Zn^{2+}/Zn; Ag^{+}/Ag$
1.1. Reproduire les deux axes de la classification électrochimique et classer ces trois couples sur les axes.
1.2. A l’aide de quel$(s)$ réducteur(s) appartenant à ces couples peut-on réduire:
1.2.1. L’ion $Ag^{+}$?
1.2.2. L’ion $Fe^{2+}$?
1.3. A l’aide de quel$(s)$ oxydant$(s)$ appartenant à ces couples peut-on oxyder:
1.3.1. Le fer?
1.3.2. Le zinc
2. Soient les couples redox suivants: $Ag+/Ag; Fe^{2+} / Fe; Al^{3+}/ Al$.
2.1. A l’aide de la classification électrochimique, prévoir la réaction spontanée d’oxydoréduction ayant lieu entre les couples redox:
2.1.1. $Fe^{2+}/Fe et Ag^{+}/Ag $
2.1.2. $Al^{3+}/Al$ et $Fe^{2+}/Fe $
2.2. Ecrire, dans chaque cas, l’équation-bilan correspondante.
EXERCICE 14
1.1. Parmi les espèces chimiques suivantes: $Ag, Ag^{+}, Zn, Zn^{2+}$ et en vous aidant de la classification électrochimique indiquer:
1.1.1. Quel est l’oxydant le plus fort?
1.1.2. Quel est le réducteur le plus fort?
1.2. Indiquer, parmi ces quatre espèces, celles qui peuvent donner lieu à une réaction spontanée d’oxydoréduction entre elles.
1.3. Ecrire l’équation-bilan de la réaction qui s’effectue.
2. On utilise une solution de nitrate de plomb:
2.1. Quelle est l’équation de la réaction qui se produit quand on plonge dans celle-ci une lame de fer?
2.2. Le fer étant en excès par rapport aux ions $Pb^{2+}$, comment peut-on caractériser les ions formés une fois la réaction terminée?
