ENERGIE ELECTRIQUE MISE EN JEU DANS UN CIRCUIT ELECTRIQUE
EXERCICE 1
Un générateur de force électromotrice $E = 6,0 V$ et de résistance interne $r = 10Ω$, est connecté, en série, à un rhéostat de résistance maximale égale à 90 $Ω$ et à une résistance de protection $R_{p} = 220 Ω 1$.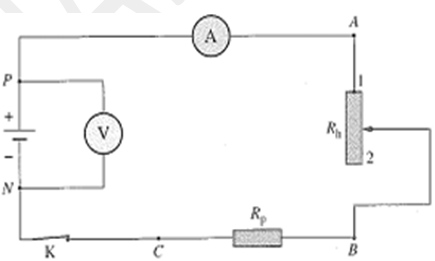
On veut mesurer la tension $U_{PN}$ et l’intensité $I$ du courant électrique.
