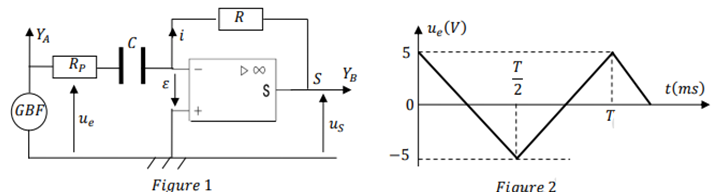
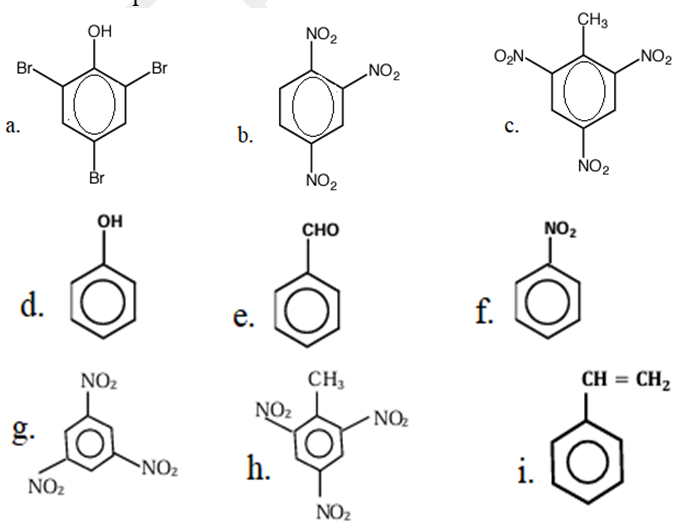
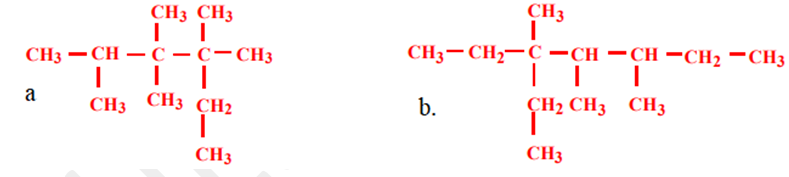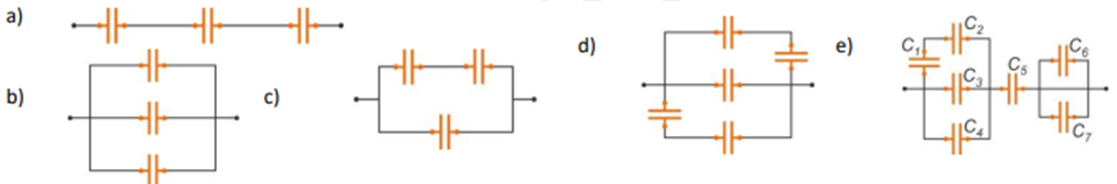Production, transport et utilisation de l'énergie éclectique
Exercice 1
A notre époque, et sans électricité, la vie quotidienne serait difficilement envisageable.
Il est donc nécessaire de savoir la produire de manière efficace et continue.
Pour répondre à la consommation croissante d'électricité, il a fallu inventer et construire des usines capables de produire de l'électricité en grande quantité.
Les trois principaux modes de production sont les centrales nucléaires, les centrales à combustibles fossiles et les centrales hydroélectriques.