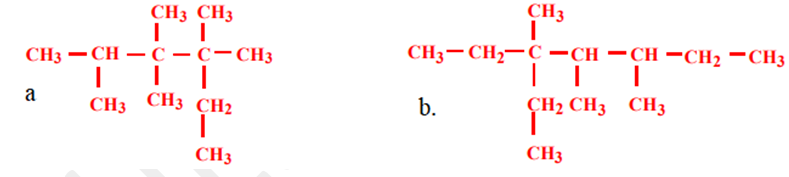HYDROCARBURES INSATURES : ALCENES ET ALCENES
EXERCICE 1
1. Donner les noms des composés suivants:
a. $CH_{3}-CH(C_{2}H_{5})-CH = CH-CH_{2}-CH(CH_{3})-CH_{3} $
b.$ C(CH_{3})_{3}-C ≡C-CH(CH_{3})-CH_{3}$
2. Donner les formules semi-développées des composés suivants:
a.$ 3-méthylpent-1-éne $
b. $2, 6,6-triméthylhept-3-éne $
c.$(E)hex -2-éne,$
d. $(Z)-1,2-dichloroprop-1-éne, $
e/$ 4,5- diméthylhex-2-yne, $